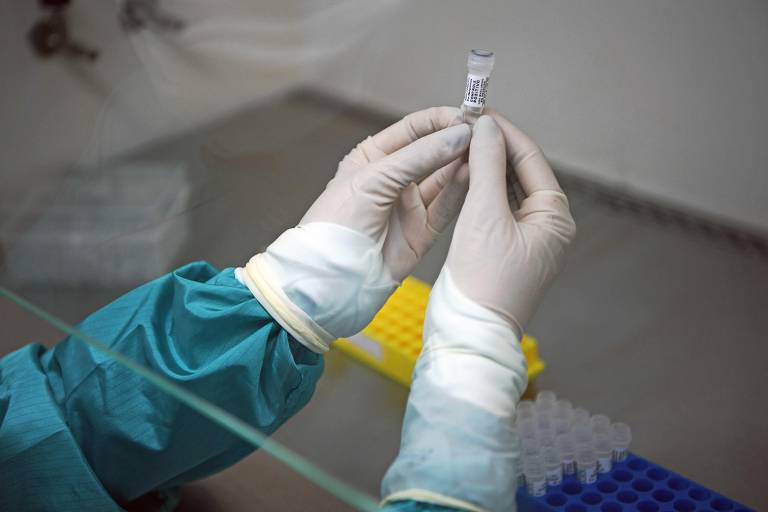
Após oito anos de discussões, a Câmara dos Deputados aprovou na quarta passada (29) o projeto de lei que cria novas regras para a pesquisa clínica com seres humanos. Com a mudança, deve ser reduzido o prazo para a aprovação dos ensaios clínicos.
O projeto, apresentado em 2015 pela ex-senadora Ana Amélia, segue novamente para o Senado com boas chances de aprovação por já ter sido aprovado anteriormente naquela casa.
O governo Luiz Inácio Lula da Silva (PT), porém, fez manifestações contrárias ao projeto, endossadas pelo CNS (Conselho Nacional de Saúde).
Para eles, as novas regras podem enfraquecer salvaguardas que hoje defendem as pesquisas científicas com seres humanos, como a existência da Conep (Comissão Nacional de Ética em Pesquisa), que, segundo eles, perderia suas funções.
Em um posicionamento enviado ao Congresso, a atual gestão defende que a Conep continue à frente do acompanhamento de pesquisas em seres humanos.
Criada em 1996, a comissão tem composição multidisciplinar com participação de pesquisadores, estudiosos de bioética, juristas, profissionais de saúde, das ciências sociais, humanas e exatas e representantes de usuários.
Outra questão polêmica do projeto diz respeito aos direitos dos participantes voluntários das pesquisas e aos deveres do pesquisador, patrocinador e entidades envolvidas.
Pelas regras atuais, o tratamento deve ser fornecido pelas farmacêuticas de forma permanente e gratuita aos pacientes que participaram dos experimentos clínicos.
Já o texto aprovado garante a continuidade do fornecimento do medicamento ao paciente participante pelas fabricantes durante cinco anos após a pesquisa ser certificada ou o remédio já estar no comércio. Depois disso, passa ser obrigação do governo garantir a continuidade do tratamento.
A Interfarma (Associação da Indústria Farmacêutica de Pesquisa) comemorou a aprovação do projeto e considera que ele é decisivo para pôr o Brasil entre os dez primeiros países no ranking global de pesquisa clínica.
Para Renato Porto, presidente-executivo da Interfarma, as manifestações do governo federal contrárias ao projeto são "contrapontos técnicos".
"O texto aprovado pela Câmara traz benefícios para os centros de pesquisa e pesquisadores, para a indústria e, principalmente, para os pacientes participantes dos estudos clínicos", diz ele.
Na sua opinião, as regras atuais para a pesquisa clínica têm uma série de "obstáculos técnicos", como a cobertura pós-estudo vitalícia, sistema duplo de avaliação de ética e pesquisa e tempo de análise e aprovação sanitária e ética.
"São pontos que nos colocam em desvantagem competitiva em relação aos outros países em busca de investimentos em saúde."
Em 2022, o Brasil ocupou a 20ª posição no ranking global, com apenas 2% dos estudos clínicos realizados no mundo. A colocação representa uma queda em relação ao percentual de estudos iniciados no país, que era de 2,3% em 2013.
Países como Turquia, Taiwan e Egito, com menor PIB, população e mercado farmacêutico, ultrapassaram o Brasil no ranking entre 2013 e 2022. "A aprovação do PL pode nos ajudar a atingir a 10ª colocação, ocupada atualmente pela Itália", diz Porto.
Segundo estudo da Interfarma, se alcançar a 10ª posição, o Brasil poderá atrair um investimento estimado de R$ 3 bilhões/ano, com efeitos na economia ainda maiores, em torno de R$ 5 bilhões/ano.
De acordo com o novo projeto, a Anvisa (Agência Nacional de Vigilância Sanitária) terá 90 dias para analisar petições primárias de ensaios clínicos com seres humanos para fins de registro sanitário do produto sob investigação.
A exceção será para produtos complexos, cujo prazo sobe para 120 dias. Segundo estudos do setor farmacêutico, atualmente, o prazo de análise pela agência chega a ultrapassar 200 dias.
Sobre a participação voluntária e sem remuneração em pesquisas com seres humanos, o projeto diz que será necessário que os interessados apresentem um termo de consentimento livre e esclarecido assinado pelo participante ou seu representante legal.
Se o participante vier a sofrer eventuais danos por sua participação na pesquisa, a nova legislação determina ainda uma indenização. Caberá ao patrocinador da pesquisa pagar essa indenização e também a assistência.
Caso a pesquisa seja patrocinada por governos, agências governamentais nacionais ou internacionais, ou instituições sem fins lucrativos, a instituição de pesquisa brasileira poderá assumir as responsabilidades pela indenização, isentando os patrocinadores.
Caso a pesquisa envolva ensaios clínicos de fase 1 ou de bioequivalência, como os realizados para atestar a funcionalidade de vacinas ou a efetividade de medicamentos genéricos, os voluntários poderão receber remuneração.
O voluntário poderá desistir a qualquer momento, sem ônus ou prejuízo para si. Além disso, ele terá direito ao ressarcimento de despesas com transporte ou alimentação, ainda que envolvam seus acompanhantes.
Segundo o projeto, se a pesquisa for de interesse estratégico para o SUS, ela terá prioridade na análise ética e contará com procedimentos especiais de análise.
Nenhum comentário:
Postar um comentário