Na guerra contra doenças emergentes, a teoria da evolução é, quase invariavelmente, uma das armas mais poderosas do nosso arsenal. Afinal de contas, no caso do novo coronavírus, assim como já ocorreu com o HIV e com muitos outros patógenos, estamos tendo o desprazer de presenciar o que acontece quando um parasita realiza uma pirueta darwinista, saltando entre espécies diferentes de hospedeiros e arrasando terrenos biológicos antes virgens —os corpos de (por enquanto) mais de 3 milhões de pessoas.
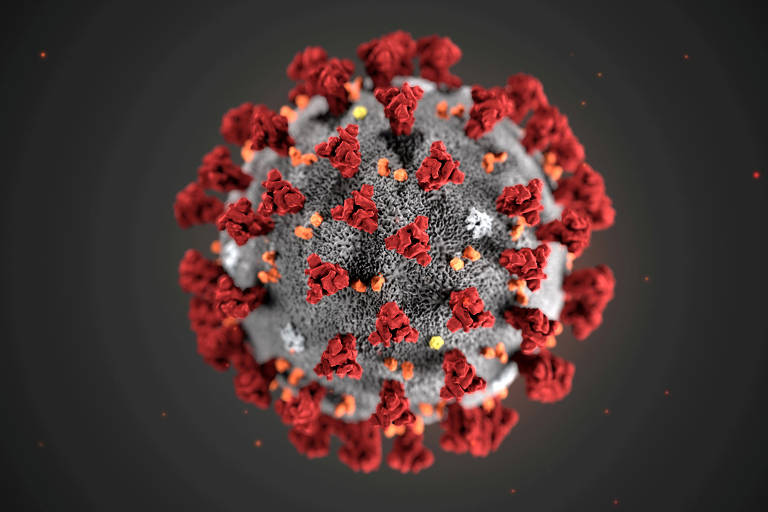
Apesar da enxurrada de estudos sobre o Sars-CoV-2, causador da moléstia Covid-19, ainda sabemos pouco sobre como esse processo se desenrolou. Uma peça importante desse quebra-cabeças acaba de ser colocada em seu devido lugar por pesquisadores brasileiros. Eles compararam as características moleculares da “porta” usada pelo vírus para adentrar as células em dezenas de espécies diferentes de mamíferos e em várias populações humanas, mostrando que o invasor microscópico provavelmente se adaptou com precisão para invadir o Homo sapiens.
A pesquisa, que deve ser publicada em breve no periódico especializado Genetics and Molecular Biology, é assinada por Maria Cátira Bortolini, Bibiana Sampaio de Oliveira e Vinicius Sortica, da UFRGS (Universidade Federal do Rio Grande do Sul), junto com colegas da USP. O grupo decidiu analisar em detalhes a trajetória evolutiva da ECA2, molécula da superfície das células à qual o coronavírus se acopla durante o processo de invasão.
Em condições normais, a ECA2 desempenha um importante papel na produção de substâncias que regulam a pressão sanguínea, mas o Sars-CoV-2 “aprendeu” a utilizá-la como uma fechadura (ou, para usar o termo técnico, um receptor) no qual enganchar a proteína S, presente em sua superfície.
Para que a “chave” do vírus se encaixe na fechadura da célula, é preciso que os formato tridimensionais de ambas sejam compatíveis entre si, tal como ocorre em uma porta do mundo macroscópico. E esse formato depende, por sua vez, do material genético do vírus e do hospedeiro, já que o genoma é que contém a receita para a produção de ambas as moléculas. Mudanças na receita alteram a composição química das moléculas e, portanto, sua forma 3D.
Bortolini e seus colegas compararam as “letras” de DNA da receita da ECA2 presentes no genoma de 70 espécies de mamíferos, de morcegos (possível origem do coronavírus) a porquinhos-da-índia, levando em conta 30 trechos da proteína diretamente associados à conexão com o vírus.
A conclusão, por um lado, é um alívio para quem teme que outros animais, inclusive os domésticos, funcionem como reservatórios da doença. As diferenças entre a ECA2 humana e a dos demais mamíferos em geral é muito alta, o que diminui a probabilidade de que o vírus afete os bichos.
Por outro lado, comparando o genoma de pessoas de todos os continentes, ficou claro que quase não há variação na ECA2 humana. Ou seja, ao que parece todos os membros da nossa espécie estão igualmente vulneráveis à invasão do coronavírus (até porque ele acabou de ter contato com os seres humanos; não daria tempo de a seleção natural favorecer a resistência a ele).
A única exceção, no que diz respeito a outros mamíferos, são os primatas do Velho Mundo, em especial os grandes símios (chimpanzés, gorilas etc.). A ECA2 desses primos do homem, na região à qual o vírus se conecta, é idêntica à nossa. Assim como outros vírus respiratórios humanos, o Sars-CoV-2 talvez tenha potencial para colocá-los em risco também.


























Nenhum comentário:
Postar um comentário